Contents
ThoughtCo / Hilary Allison
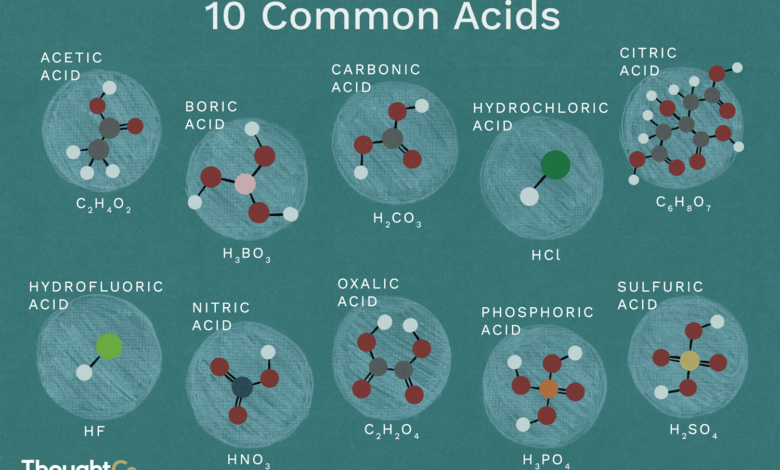
Voici une liste de dix acides courants ayant une structure chimique. Les acides sont des composés qui se dissocient dans l’eau pour donner des ions hydrogène/protons ou pour accepter des électrons.
Acide acétique
L’acide acétique est également connu sous le nom d’acide éthanoïque.
Acide acétique : HC2H3O2Aussi appelé : acide éthanoïque, CH3COOH, AcOH.L’acide acétique se trouve dans le vinaigre. Le vinaigre contient entre 5 et 20 % d’acide acétique. Cet acide faible se trouve le plus souvent sous forme liquide. L’acide acétique pur (glacial) se cristallise juste en dessous de la température ambiante.
Acide borique
C’est la structure chimique de l’acide borique : le bore (rose), l’hydrogène (blanc) et l’oxygène (rouge).
Acide borique : H3BO3Aussi appelé : acidum boricum, orthoborate d’hydrogène
L’acide borique peut être utilisé comme désinfectant ou pesticide. On le trouve généralement sous forme de poudre cristalline blanche. Le borax (tétraborate de sodium) est un composé apparenté bien connu.
Acide carbonique
C’est la structure chimique de l’acide carbonique.
Acide carbonique : CH2O3Aussi appelé : acide aérien, acide de l’air, carbonate de dihydrogène, kihydroxycétone.
Les solutions de dioxyde de carbone dans l’eau (eau gazéifiée) peuvent être appelées acide carbonique. C’est le seul acide excrété par les poumons sous forme de gaz. L’acide carbonique est un acide faible. Il est responsable de la dissolution du calcaire pour produire des caractéristiques géologiques telles que les stalagmites et les stalactites.
Acide citrique
L’acide citrique est un acide faible présent dans les agrumes et utilisé comme conservateur naturel et pour donner un goût aigre. Les atomes sont représentés sous forme de sphères et sont codés par des couleurs : carbone (gris), hydrogène (blanc) et oxygène (rouge).
Acide citrique : H3C6H5O7
Aussi appelé : acide 2-hydroxy-1,2,3-propanetricarboxylique.
L’acide citrique est un acide organique faible qui tire son nom du fait qu’il s’agit d’un acide naturel des agrumes. Il s’agit d’une espèce intermédiaire dans le cycle de l’acide citrique, qui est essentiel au métabolisme aérobie. L’acide est largement utilisé comme aromatisant et acidifiant dans les aliments. L’acide citrique pur a un goût piquant et acidulé.
Acide chlorhydrique
C’est la structure chimique de l’acide chlorhydrique : le chlore (vert) et l’hydrogène (blanc).
Acide chlorhydrique : HCl
Aussi connu sous le nom d’acide marin, de chloronium, d’esprit de sel.
L’acide chlorhydrique est un acide fort, clair et très corrosif. On le trouve sous forme diluée, comme l’acide muriatique. Ce produit chimique a de nombreuses utilisations industrielles et de laboratoire. L’acide muriatique à usage industriel est généralement composé de 20 à 35 % d’acide chlorhydrique, tandis que l’acide muriatique à usage domestique se situe entre 10 et 12 % d’acide chlorhydrique. Le HCl est l’acide que l’on trouve dans le suc gastrique.
Acide fluorhydrique
C’est la structure chimique de l’acide fluorhydrique : fluor (cyan) et hydrogène (blanc).
Acide fluorhydrique : HFA aussi appelé : fluorure d’hydrogène, hydrofluorure, monofluorure d’hydrogène, acide fluorhydrique.
Bien qu’il soit très corrosif, l’acide fluorhydrique est considéré comme un acide faible car il ne se dissocie généralement pas complètement. L’acide mange le verre et les métaux, c’est pourquoi le HF est stocké dans des conteneurs en plastique. En cas de déversement sur la peau, l’acide fluorhydrique passe à travers les tissus mous pour attaquer les os. L’HF est utilisé pour fabriquer des composés fluorés, dont le téflon et le prozac.
Acide nitrique
C’est la structure chimique de l’acide nitrique : hydrogène (blanc), azote (bleu) et oxygène (rouge).
Acide nitrique : HNO3Aussi appelé : aqua fortis, acide azotique, acide de gravure, nitroalcool.
L’acide nitrique est un acide minéral fort. A l’état pur, c’est un liquide incolore. Avec le temps, il prend une couleur jaune en se décomposant en oxydes d’azote et en eau. L’acide nitrique est utilisé pour fabriquer des explosifs et des encres et comme oxydant puissant pour l’industrie et les laboratoires.
Acide oxalique
C’est la structure chimique de l’acide oxalique.
Acide oxalique : H2C2O4
Aussi appelé : acide éthanedioïque, hydrogénoalate, éthanedionate, acidum oxalicum, HOOCCOOH, acide oxirique.
L’acide oxalique doit son nom au fait qu’il a d’abord été isolé sous forme de sel d’oseille (Oxalis sp.). L’acide est relativement abondant dans les aliments verts et feuillus. On le trouve également dans les nettoyants pour métaux, les produits antirouille et certains types d’eau de Javel. L’acide oxalique est un acide faible.
Acide phosphorique
L’acide phosphorique est également connu sous le nom d’acide orthophosphorique ou d’acide phosphorique(V).
Acide phosphorique : H3PO4Aussi appelé : acide orthophosphorique, phosphate de trihydrogène, acidum phosphoricum.
L’acide phosphorique est un acide minéral utilisé dans les produits d’entretien ménager, comme réactif chimique, comme inhibiteur de rouille et comme décapant dentaire. L’acide phosphorique est également un acide important en biochimie. C’est un acide fort.
Acide sulfurique
C’est la structure chimique de l’acide sulfurique.
Acide sulfurique : H2SO4Aussi appelé : acide de batterie, acide de trempage, acide de matage, Terra Alba, huile de vitriol.
L’acide sulfurique est un acide fort minéral corrosif. Bien que normalement clair à légèrement jaune, il peut être teinté en brun foncé pour attirer l’attention sur sa composition. L’acide sulfurique provoque de graves brûlures chimiques, ainsi que des brûlures thermiques dues à la réaction de déshydratation exothermique. L’acide est utilisé dans les batteries au plomb, les nettoyeurs de canalisations et la synthèse chimique.
Points clés
- Les acides sont courants dans la vie quotidienne. Ils se trouvent dans les cellules et le système digestif, sont naturellement présents dans les aliments et sont utilisés pour de nombreuses réactions chimiques courantes.
- Les acides forts les plus courants sont l’acide chlorhydrique, l’acide sulfurique, l’acide phosphorique et l’acide nitrique.
- Les acides faibles les plus courants sont l’acide acétique, l’acide borique, l’acide fluorhydrique, l’acide oxalique, l’acide citrique et l’acide carbonique.








