Contents
La molarité est une unité de chimie qui quantifie la concentration d’une solution en mesurant les moles de soluté par litre de solution. Le concept de molarité peut être difficile à saisir, mais avec suffisamment de pratique, vous pourrez convertir la masse en moles en un rien de temps. Utilisez cet exemple de calcul de la molarité d’une solution de sucre pour vous exercer. Le sucre (le soluté) est dissous dans l’eau (le solvant).
Exemple de problème de calcul de la molarité
Dans ce problème, un morceau de sucre de quatre grammes (saccharose : C12H22O11) est dissous dans une tasse d’eau chaude de 350 millilitres. Trouvez la molarité de la solution sucrée.
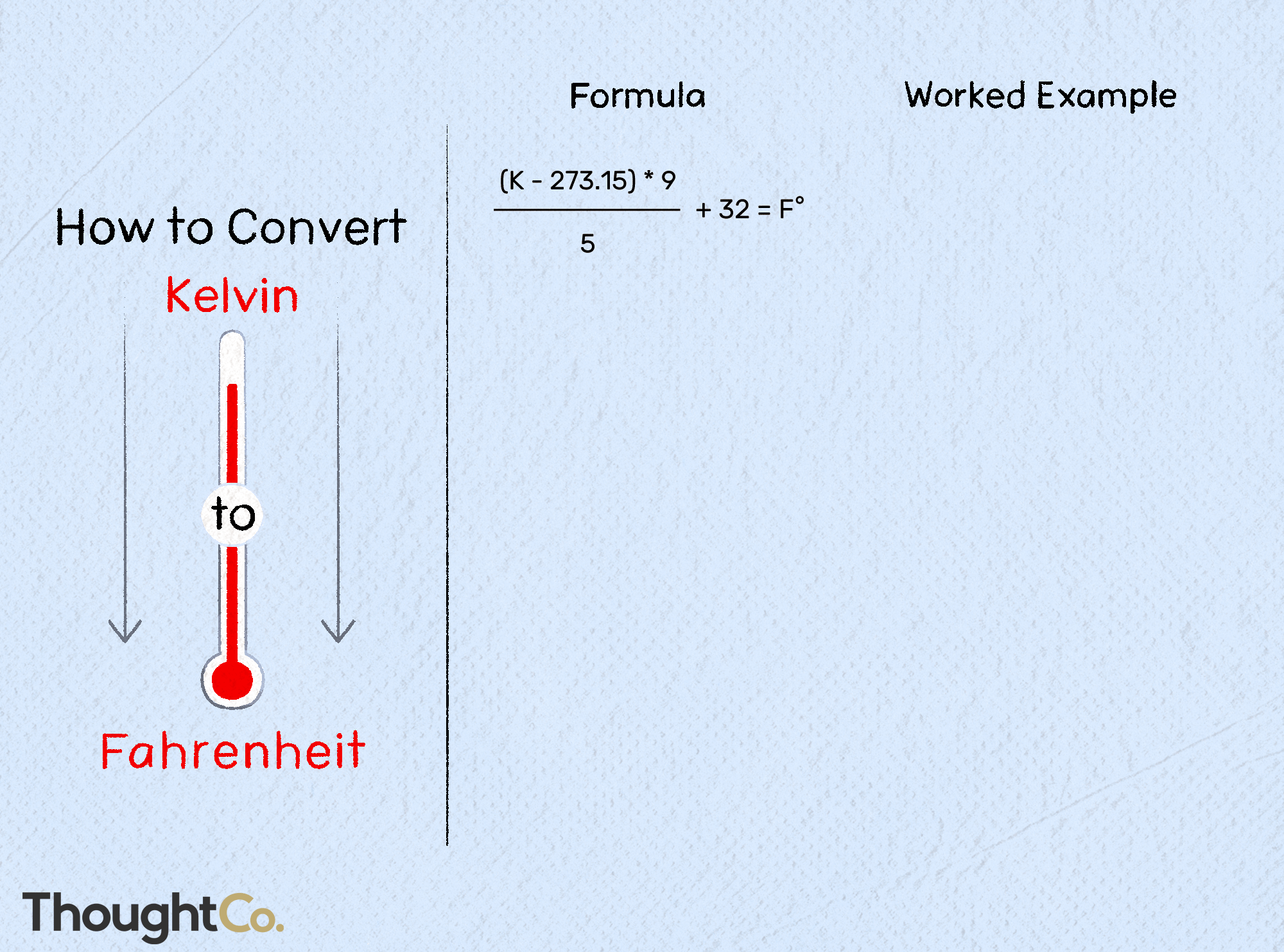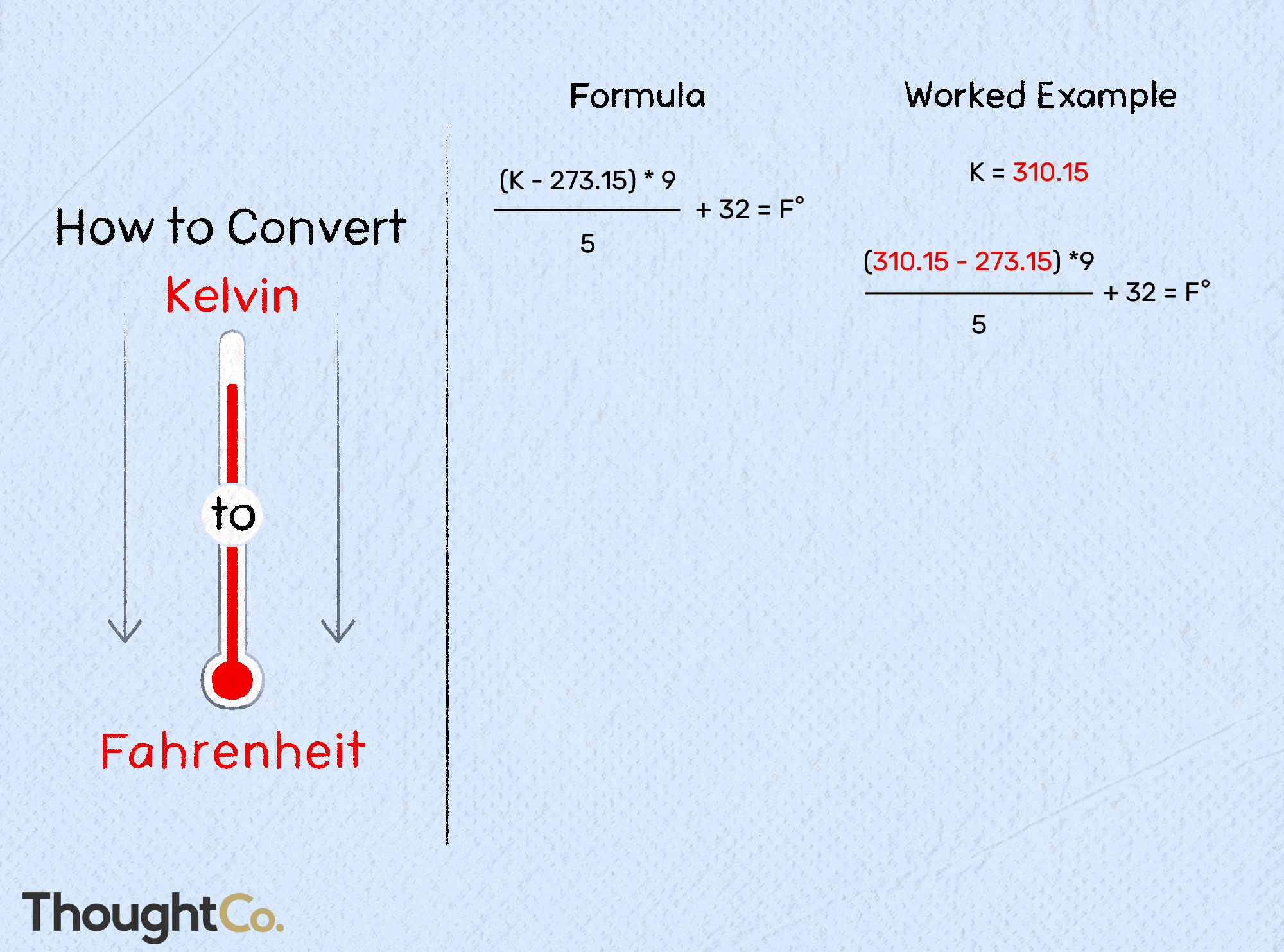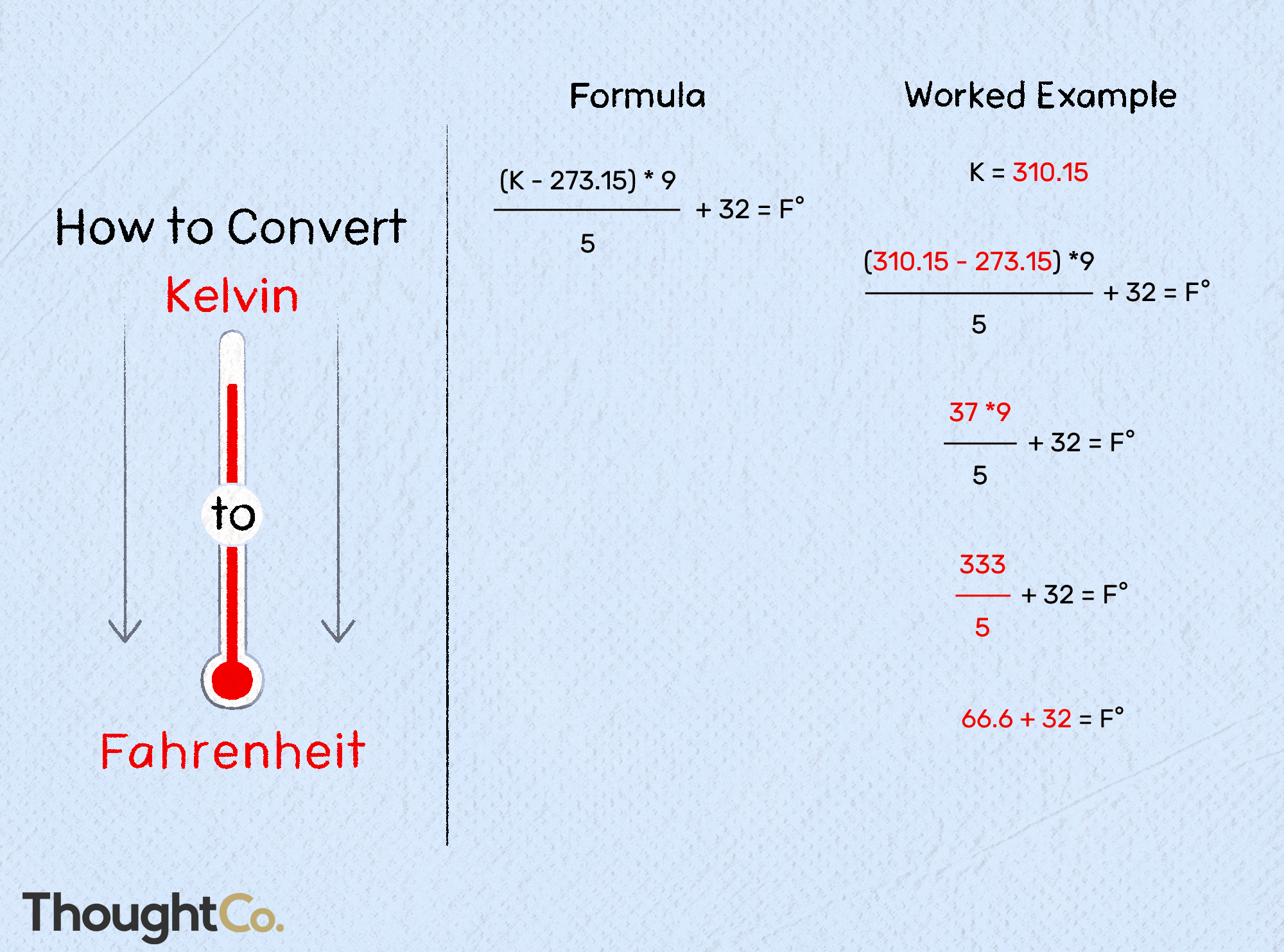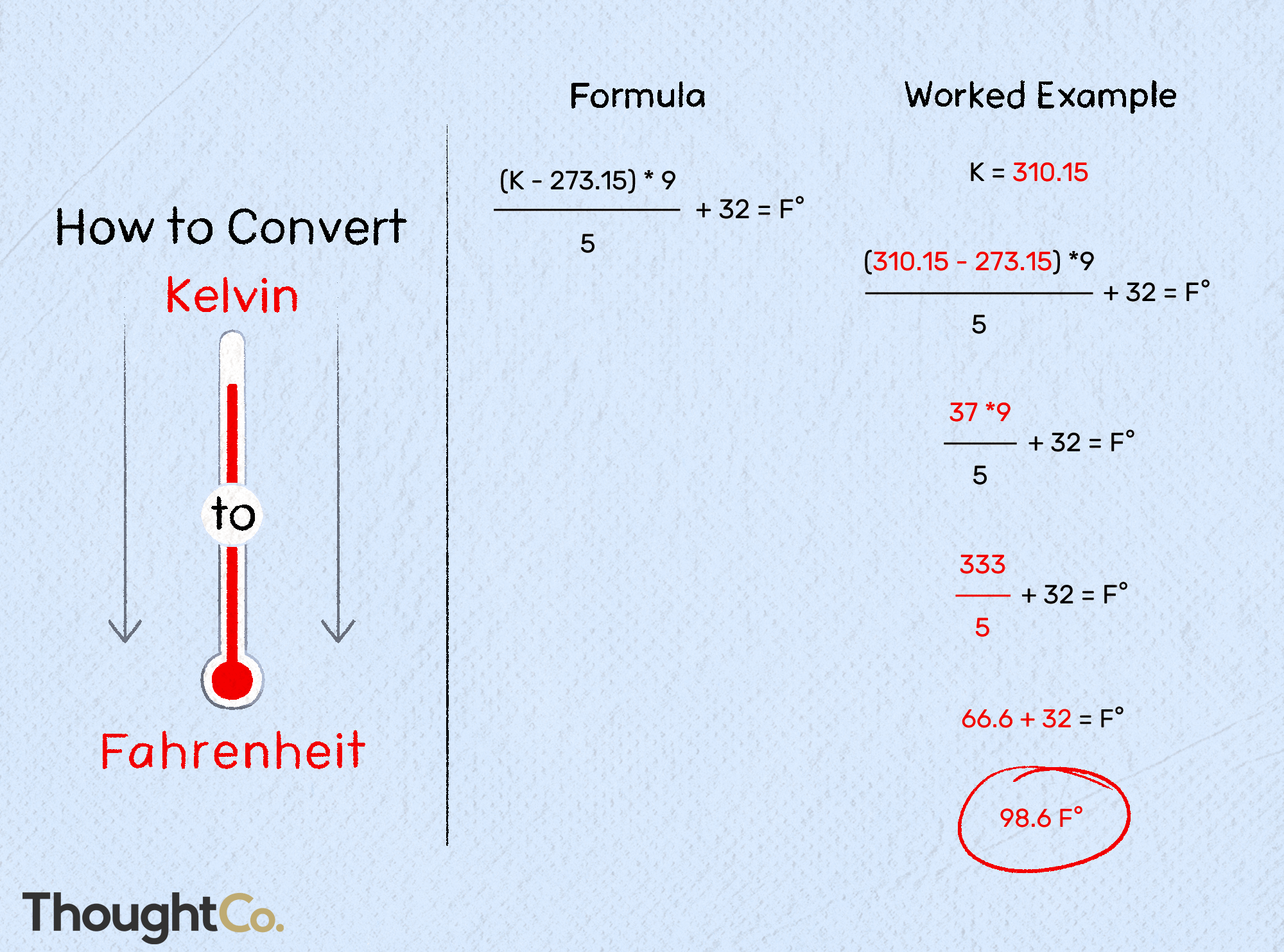
Commencez par l’équation de la molarité : M (molarité) = m/V
Ensuite, utilisez l’équation et suivez ces étapes pour calculer la molarité.
Étape 1 : Déterminer les grains de beauté du soluté
La première étape du calcul de la molarité consiste à déterminer le nombre de moles dans quatre grammes de soluté (saccharose) en trouvant la masse atomique de chaque atome dans la solution. Cela peut être fait en utilisant le tableau périodique. La formule chimique du saccharose est C12H22O11 : 12 carbone, 22 hydrogène et 11 oxygène. Vous devrez multiplier la masse atomique de chaque atome par le nombre d’atomes de cet élément dans une solution.
Pour le saccharose, il faut multiplier la masse d’hydrogène (qui est d’environ 1) par le nombre d’atomes d’hydrogène (22) dans le saccharose. Vous devrez peut-être utiliser des chiffres plus significatifs pour les masses atomiques pour vos calculs, mais pour cet exemple, seul un chiffre significatif a été donné pour la masse du sucre, donc un chiffre significatif pour la masse atomique est utilisé.
Une fois que vous avez le produit de chaque atome, additionnez les valeurs pour obtenir le total des grammes par mole de saccharose. Voir le calcul ci-dessous.
C12H22O11 = (12)(12) + (1)(22) + (16)(11)C12H22O11 = 144 + 22+ 176C12H22O11 = 342 g/mol
Pour obtenir le nombre de moles dans une masse spécifique de solution, il faut diviser la masse en grammes par le nombre de grammes par mole dans l’échantillon. Voir ci-dessous.
4 g/(342 g/mol) = 0,0117 mol
Étape 2 : Déterminer le volume de la solution en litres
En fin de compte, il faut connaître le volume de la solution et du solvant, et non celui de l’un ou de l’autre. Souvent, cependant, la quantité de soluté dissous dans une solution ne change pas suffisamment le volume de la solution pour affecter votre réponse finale, vous pouvez donc simplement utiliser le volume de solvant. Les exceptions à cette règle sont souvent précisées dans les instructions d’un problème.
Pour cet exemple, il suffit de convertir des millilitres d’eau en litres.
350 ml x (1L/1000 ml) = 0,350 L
Étape 3 : Déterminer la molarité de la solution
La troisième et dernière étape consiste à insérer les valeurs obtenues aux étapes 1 et 2 dans l’équation de molarité. Branchez 0,0117 mol pour m et 0,350 pour V.
M = m/VM = 0,0117 mol/0,350 LM = 0,033 mol/L
Réponse
La molarité de la solution de sucre est de 0,033 mol/L.
Conseils pour réussir
Veillez à utiliser le même nombre de chiffres significatifs, que vous auriez dû obtenir dans le tableau périodique, tout au long de votre calcul. Si vous ne le faites pas, vous risquez de donner une réponse incorrecte ou imprécise. En cas de doute, utilisez le nombre de chiffres significatifs qui vous ont été fournis dans le problème dans la masse de soluté.
Gardez à l’esprit que toutes les solutions ne sont pas constituées d’une seule substance. Pour les solutions obtenues en mélangeant deux ou plusieurs liquides, il est particulièrement important de trouver le volume correct de la solution. Vous ne pouvez pas toujours additionner les volumes de chaque liquide pour obtenir le volume final. Si vous mélangez de l’alcool et de l’eau, par exemple, le volume final sera inférieur à la somme des volumes d’alcool et d’eau. Le concept de miscibilité entre en jeu ici et dans des exemples comme celui-ci.